L’agricoltura e la produzione alimentare devono diventare più sostenibili, in un contesto mondiale di aumento della popolazione e del livello di vita, di cambiamenti climatici e di degrado ambientale.
Un’agricoltura sostenibile, ma anche anche meno dipendente dalle importazioni.
Il Green Deal1 della Commissione europea, recentemente pubblicato nel contesto della strategia Farm to Fork2, afferma che l’UE deve sviluppare modi innovativi per ridurre la dipendenza da fitofarmaci e fertilizzanti, invertire la tendenza alla perdita di biodiversità e allo stesso tempo fornire alla società cibo sufficiente, nutriente, sostenibile e conveniente. La strategia è in linea con l’importanza dell’alimentazione e dell’agricoltura nel raggiungimento degli Obiettivi di Sviluppo Sostenibile delle Nazioni Unite3.

Oltre a raggiungere questi obiettivi, e per riprenderci dalla crisi innescata dalla pandemia da COVID-19, è necessario sviluppare un’agricoltura altamente produttiva e sostenibile, meno dipendente dalle importazioni extra UE.
Tuttavia, fissare gli obiettivi non è sufficiente. è infatti necessario implementare gli strumenti che consentano di raggiungerli. Tutti gli approcci possibili, incluse le tecnologie innovative di miglioramento genetico delle piante, sono da utilizzare per affrontare queste sfide e raggiungere gli ambiziosi obiettivi della strategia Farm to Fork.
Tecnologie di editing del genoma: meno farmaci, alimenti più resistenti e sani.
Lo strumento più recente e innovativo per lo sviluppo di nuove varietà è rappresentato dalle tecnologie per l’evoluzione assistita (TEA). Queste tecnologie, note anche come tecnologie di editing del genoma, consentono a scienziati e genetisti di sviluppare nuove varietà in modo più rapido, relativamente semplice e molto più preciso rispetto alle precedenti metodologie di miglioramento. Le TEA hanno applicazioni di vasta portata quali l’aumento della diversità delle colture, la riduzione dell’uso dei fitofarmaci, lo sviluppo di alimenti più sani e molte altre.
Una maggiore biodiversità delle specie coltivate non è solo auspicabile, ma di importanza centrale sia per l’agricoltura sostenibile sia per un’alimentazione sana. L’uso di varietà più diversificate può aumentare la capacità di resilienza ai cambiamenti climatici. Questa diversità è particolarmente importante per affrontare efficacemente gli effetti negativi dei cambiamenti climatici perché contribuisce ad una miglior gestione dei parassiti e delle malattie, che riducono le rese e la qualità dei prodotti4.
Le TEA consentono di introdurre nelle piante tratti utili a partire da varietà normalmente trascurate o direttamente dai parenti selvatici, di facilitare la coltivazione di varietà tradizionali o mettere in coltura nuove specie, come dimostrato da esperimenti pionieristici nel pomodoro26-28.
Le TEA possono ridurre considerevolmente la dipendenza dai fitofarmaci migliorando la resistenza alle malattie, come illustrato da esempi recenti, con lo sviluppo di frumento resistente all’oidio5,6, vite resistente alla muffa grigia7, riso resistente al brusone8, pomodoro resistente a malattie batteriche9, pompelmo resistente al cancro degli agrumi10, riso resistente alla ruggine batterica11-13. Anche l’inquinamento dovuto a fungicidi basati sull’uso di metalli pesanti potrebbe essere significativamente ridotto grazie alle TEA.
Il cibo sano è la base di una dieta sana. Le TEA accelerano il miglioramento dei caratteri nutrizionali nella frutta e verdura che attualmente consumiamo. Ne sono esempi il frumento ad alto contenuto di fibre14, le patate a basso contenuto di acrilamide15, il frumento a basso contenuto di glutine16, la riduzione del contenuto di allergeni e metalli pesanti tossici in cereali, legumi e semi oleosi17-22.
Tecnologie per l’evoluzione assistita come volano in tutto il mondo, mentre in Italia stiamo a guardare.
Purtroppo lo sviluppo di varietà con caratteristiche migliori attraverso le nuove tecnologie più rapide e molto più precise è bloccato in Europa, mentre il resto del mondo le accoglie con favore.
La sentenza della Corte di Giustizia Europea del 25 luglio 2018 nella causa C-528/1623, che assoggetta le piante modificate tramite TEA alle restrittive disposizioni della legislazione europea sugli OGM, impedisce infatti l’uso di queste tecnologie per il miglioramento genetico delle colture in Europa.
L’approccio normativo sulla modifica del genoma delle piante in Europa è completamente disallineato rispetto a quello applicato in altri Paesi che hanno adottato normative più idonee allo scopo. La mancanza di armonizzazione normativa pone problemi nel commercio globale e nel settore delle sementi e ostacola l’innovazione e il progresso scientifico in Europa, necessario per raggiungere obiettivi di sviluppo sostenibile e del Green Deal.
La figura seguente tratta da Schmidt et al. (2020) fornisce una panoramica globale degli approcci normativi attualmente implementati o discussi in diversi paesi per regolamentare l’approvazione di colture con genoma modificato24.
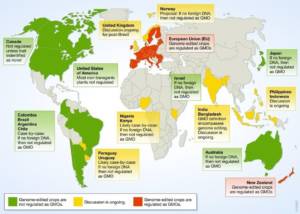
L’appello degli scienziati per fugare le fobie sulla genetica e allinearci con il resto del mondo.
La rete Europea per l’Agricoltura Sostenibile attraverso l’Editing del Genoma (EU-SAGE)25 con membri di 132 istituti e associazioni di ricerca europei, raccomanda vivamente al Consiglio Europeo, al Parlamento Europeo e alla Commissione Europea quanto segue:
li scienziati europei chiedono di rivedere l’attuale Direttiva sugli OGM (2001/18/EC) affinché tenga in considerazione le attuali conoscenze scientifiche ed evidenze sull’editing del genoma. Inoltre, l’editing del genoma che porti all’introduzione di cambiamenti che possono anche verificarsi in modo naturale o che introducono DNA già presente nel corredo genetico della specie o di specie interfeconde dovrebbe essere esentato dall’applicazione della legislazione sugli OGM. Nel regolamentare l’editing del genoma, il legislatore dovrebbe anche considerare i vantaggi di questa tecnologia, compresi gli svantaggi di non adottarla.
La modifica del genoma offre una gamma crescente di soluzioni per una selezione più efficiente di colture resistenti agli estremi climatici, meno dipendenti da fertilizzanti e fitofarmaci e che aiutano a preservare le risorse naturali. Chiediamo che la Commissione Europea accolga le proposte qui contenute a beneficio di tutti i cittadini dell’UE.
Mentre la legislazione di molti paesi extra UE facilita l’uso dell’editing del genoma, la legislazione dell’UE distingue le colture a seconda che siano prodotte tramite modifica del genoma o tramite metodi di miglioramento tradizionali. È urgente l’armonizzazione del quadro normativo in tutto il mondo.
Settori importanti della società europea non sono consapevoli del valore dell’innovazione in agricoltura, necessaria anche per preservare le varietà tradizionali. È necessaria una nuova narrativa per la produzione alimentare in Europa che includa l’importanza di approcci innovativi e più efficienti nell’intera catena del valore dell’agricoltura e dei suoi prodotti.
Riferimenti bibliografici:
- https://eur-lex.europa.eu/resource.html?uri=cellar:b828d165-1c22-11ea-8c1f- 0002.02/DOC_1&format=PDF
- https://eur-lex.europa.eu/resource.html?uri=cellar:ea0f9f73-9ab2-11ea-9d2d- 0001.02/DOC_1&format=PDF
- https://www.un.org/sustainabledevelopment/sustainable-development-goals/
- http://www.fao.org/climate-smart-agriculture-sourcebook/production-resources/module-b1- crops/b1-overview/en
- Wang Y., X. Cheng, Q. Shan, Y. Zhang, J. Liu, et al., 2014 Simultaneous editing of three homoeoalleles in hexaploid bread wheat confers heritable resistance to powdery mildew. Nat. Biotechnol. 32: 947– https://doi.org/10.1038/nbt.2969.
- Zhang Y, Bai Y, Wu G, Zou S, Chen Y, Gao C, Tang D., 2017 Simultaneous modification of three homoeologs of TaEDR1 by genome editing enhances powdery mildew resistance in wheat. Plant J.; 91:714–24. https://doi.org/10.1111/tpj.13599.
- Wang X, Tu M, Wang D, Liu J, Li Y, Li Z, et al., 2018 CRISPR/Cas9-mediated efficient targeted mutagenesis in grape in the first generation. Plant Biotechnol J., 16:844–55. https://doi.org/10.1111/pbi.12832.
- Wang F, Wang C, Liu P, Lei C, Hao W, Gao Y, et al., 2016 Enhanced rice blast resistance by CRISPR/Cas9-targeted mutagenesis of the ERF transcription factor gene OsERF922. PLoS ONE. 11:e0154027. https://doi.org/10.1371/journal.pone.0154027.
- Ortigosa A, Gimenez-Ibanez S, Leonhardt N, Solano R. 2019. Design of a bacterial speck resistant tomato by CRISPR/Cas9-mediated editing of SlJAZ2. Plant Biotechnology Journal (2019) 17, pp. 665– 673.
- Jia H, Zhang Y, Orbović V, Xu J, White FF, Jones JB, Wang N., 2017 Genome editing of the disease susceptibility gene CsLOB1 in citrus confers resistance to citrus canker. Plant Biotechnol J., 15:817–23. https://doi.org/10.1111/pbi.12677.
- Zhou J, Peng Z, Long J, Sosso D, Liu B, Eom J-S, et , 2015 Gene targeting by the TAL effector PthXo2 reveals cryptic resistance gene for bacterial blight of rice. Plant J.;82:632–43. https://doi.org/10.1111/tpj.12838.
- Blanvillain-Baufumé S, Reschke M, Solé M, Auguy F, Doucoure H, Szurek B, et al., 2017 Targeted promoter editing for rice resistance to Xanthomonas oryzae pv. oryzae reveals differential activities for SWEET14-inducing TAL effectors. Plant Biotechnol J., 15:306–17. https://doi.org/10.1111/pbi.12613.
- Xie C, Zhang G, Zhang Y, Song X, Guo H, Chen X, Fang R., 2017 SRWD1, a novel target gene of DELLA and WRKY proteins, participates in the development and immune response of rice (Oryza sativa ). Sci Bull.;62:1639–48. https://doi.org/10.1016/j.scib.2017.12.002.
- https://fdc.nal.usda.gov/
- Clasen BM, Stoddard TJ, Luo S, Demorest ZL, Li J, Cedrone F, et , 2016 Improving cold storage and processing traits in potato through targeted gene knockout. Plant Biotechnol J., 14:169–76. https://doi.org/10.1111/pbi.12370.
- Sánchez-León S, Gil-Humanes J, Ozuna CV, Giménez MJ, Sousa C, Voytas DF, Barro F., 2017 Low-gluten, nontransgenic wheat engineered with CRISPR/Cas9. Plant Biotechnol J. https://doi.org/10.1111/pbi.12837.
- Haun W, Coffman A, Clasen BM, Demorest ZL, Lowy A, Ray E, et , 2014 Improved soybean oil quality by targeted mutagenesis of the fatty acid desaturase 2 gene family. Plant Biotechnol J., 12:934–40. https://doi.org/10.1111/pbi.12201.
- Demorest ZL, Coffman A, Baltes NJ, Stoddard TJ, Clasen BM, Luo S, et al., 2016 Direct stacking of sequence-specific nuclease-induced mutations to produce high oleic and low linolenic soybean oil. BMC Plant Biol., 16:225. https://doi.org/10.1186/s12870-016-0906-1.
- Wen S, Liu H, Li X, Chen X, Hong Y, Li H, et al., 2018 TALEN-mediated targeted mutagenesis of fatty acid desaturase 2 (FAD2) in peanut (Arachis hypogaea L.) promotes the accumulation of oleic acid. Plant Mol Biol., 97:177–85. https://doi.org/10.1007/s11103-018-0731-z.
- Zhou X, Liao H, Chern M, Yin J, Chen Y, Wang J, et al., 2018 Loss of function of a rice TPR-domain RNA- binding protein confers broad-spectrum disease resistance. Proc Natl Acad Sci USA.; 115:3174–9. https://doi.org/10.1073/pnas.1705927115.
- Abe K, Araki E, Suzuki Y, Toki S, Saika , 2018 Production of high oleic/low linoleic rice by genome editing. Plant Physiol Biochem. https://doi.org/10.1016/j.plaphy.04.033.
- Nieves-Cordones M, Mohamed S, Tanoi K, Kobayashi NI, Takagi K, Vernet A, et al., 2017 Production of low-Cs+ rice plants by inactivation of the K+ transporter OsHAK1 with the CRISPR–Cas system. Plant J., 92:43–56. https://doi.org/10.1111/tpj.13632.
- Judgment of the Court of Justice of 25 July 2018. Confédération Paysanne and Others v. Premier Ministre and Ministre de L’Agriculture, de l’Agroalimentaire et de la Forêt. Case C-528/16. ECLI:EU:C:2018:583. Available at: https://eur-lex.europa.eu/legal- content/EN/TXT/?qid=1590471867015&uri=CELEX:62016CJ0528
- Schmidt S.M., Belisle M., Frommer W.B. (2020). The evolving landscape around genome editing in agriculture: Many countries have exempted or move to exempt forms of genome editing from GMO regulation of crop plants. EMBO Rep 2020, e50680
- https://www.eu-sage.eu/
- Zsögön, A., Čermák, T., Naves, E. et al. De novo domestication of wild tomato using genome editing. Nat Biotechnol 36, 1211–1216 (2018). https://doi.org/10.1038/nbt.4272
- Li T, Yang X, Yu Y, et al. Domestication of wild tomato is accelerated by genome editing [published online ahead of print, 2018 Oct 1]. Nat Biotechnol. 2018;10.1038/nbt.4273. doi:10.1038/nbt.4273
- Kwon, C., Heo, J., Lemmon, Z.H. et al. Rapid customization of Solanaceae fruit crops for urban agriculture. Nat Biotechnol 38, 182–188 (2020). https://doi.org/10.1038/s41587-019-0361-2

