Contributo di Ettore Meccia – Società Italiana di Mutagenesi Ambientale e Genomica (S.I.M.A.G.)
Si sta presentando in modo sempre più solido l’evidenza di un aumento, negli ultimi decenni, sia dell’incidenza che della mortalità di diverse forme di cancro nelle fasce più giovani della popolazione, specialmente nei paesi a reddito più alto. Secondo alcune stime, tra il 1990 ed il 2019 c’è stato un aumento dell’80% dell’incidenza e del 30% della mortalità.
Un trend in controtendenza
Esclusa l’ipotesi più semplice, quella cioè che vengano scoperti più casi grazie a programmi di screening più estesi (che però non coprono la finestra temporale in questione), chi si interessa di mutagenesi ambientale, ovvero della capacità di agenti e sostanze a cui siamo esposti di indurre alterazioni a livello genetico e genomico alla base della cancerogenesi, non può non chiedersi cosa stia succedendo.
L’aumento dell’insorgenza di questi tumori definiti “early onset” (sotto i 50 anni) è un trend in controtendenza rispetto alla progressiva diminuzione sia di incidenza che di mortalità contemporaneamente in corso per molti di quei tumori nella popolazione più anziana, e non ha ancora trovato una spiegazione univoca, che probabilmente non esiste.
È probabile, infatti, che alla base di questo fenomeno non ci sia una sola causa ma diverse, che si stanno sommando e sovrapponendo.
Il fenomeno è in contrasto con l’evidenza che, salvo condizioni particolari (familiarità e background genetico), il cancro è una patologia associata all’età. Il rischio di quasi tutti i tumori, infatti, aumenta progressivamente dai 50 anni in su.
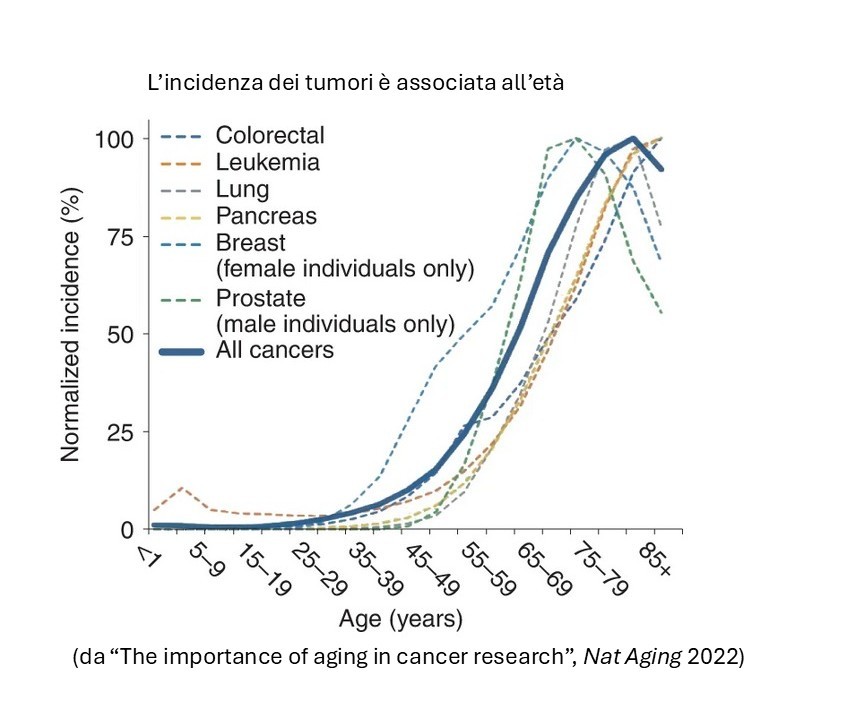
Questo vale per tutte le possibili cause del cancro, che si tratti delle conseguenze dell’esposizione ad agenti fisici, chimici, alimentazione, stili di vita, o alla dibattuta “bad luck” proposta anni fa da Vogelstein e Tomasetti come causa stocastica e non prevenibile dell’insorgenza di tumori anche senza una chiara eziologia ambientale. La trasformazione tumorale, infatti, è un evento che ha bisogno di tempo per cumulare i danni necessari all’iniziazione, e poi selezionare gli eventi necessari alla progressione.
Su questa tempistica, del resto, si basano anche i nostri programmi di prevenzione e di screening.
Tumori early onset e late onset: cosa cambia?
L’evidenza è che in una percentuale in progressivo aumento dei casi tutto questo stia succedendo più in fretta, o forse prima. Ed escludendo che siano cambiati i meccanismi di base della cancerogenesi, l’ipotesi che rimane è che sia cambiata l’esposizione della popolazione a fattori cancerogeni già noti o forse da identificare.
Spesso questi tumori vengono descritti come più aggressivi, più veloci nella progressione, più letali. Una possibilità è che i tumori early onset di fatto non siano diversi da quelli late onset, semplicemente iniziano a svilupparsi in un’età insolita, per cui da una parte sfuggono ai programmi di screening e di controllo, dall’altra generano sintomi che inizialmente non vengono associati all’ipotesi di un tumore ma ad altri fattori ritenuti meno improbabili.
In entrambe le situazioni la conseguenza è quella di arrivare alla diagnosi con un tumore ad uno stadio più avanzato.
D’altro canto, ci sono evidenze che i tumori early onset siano, almeno in alcuni casi, diversi da quelli late onset. Ormai, per esempio, è noto che i tumori del colon-retto early onset (EO-CRC, forse tra i più studiati perché quelli con un aumento più netto sia di incidenza che di mortalità) sono più frequentemente localizzati nel retto e nel colon discendente rispetto al colon ascendente. Il fatto che si tratti di tessuti con origine embrionale diversa potrebbe far pensare che alla base dei tumori early onset e late onset ci siano fattori di innesco diversi.
Le ipotesi sul tavolo sono tante, alcune molto solide e concrete, altre più difficili da verificare eppure non escludibili. Dobbiamo infatti prendere in considerazione fattori ambientali nuovi, o che hanno assunto rilevanza maggiore a partire forse dagli anni ’60 in poi, per poterne vedere i primi effetti dagli anni ’90.
L’approccio più completo potrebbe essere quello esposomico, che prenda cioè in considerazione tutto ciò a cui siamo (o siamo stati) esposti per decenni, anche perché sappiamo bene che il cancro è una patologia multifattoriale.
Il peso dei cambiamenti alimentari
I cambiamenti dal punto di vista alimentare, che molti vedono come fattore determinante, sono sicuramente agevoli da seguire. L’aumento del consumo di cibi ultraprocessati, del consumo di zuccheri, del consumo di cibo in generale (testimoniato anche dall’aumento della condizione di obesità specialmente infantile e giovanile), l’aumento del consumo di carni rosse e processate classificate rispettivamente “probabilmente cancerogene” e “cancerogene” dalla IARC nel 2015, sono dati con cui si possono fare associazioni attendibili e che daranno risultati interessanti.
Inoltre, cambiamenti nel regime alimentare hanno a loro volta conseguenze sul nostro microbiota, e le correlazioni tra microbiota, immunità e cancro (specialmente colon-retto) iniziano ad essere solide.
Il ruolo di plastiche, microplastiche e nanoplastiche
Tuttavia, l’aumento dei tumori early onset riguarda molti tipi di cancro oltre al colon-retto, per cui non ci si può limitare a considerare alimentazione, obesità e stile di vita sedentario: vanno considerati anche altri fattori ed altri meccanismi di cancerogenesi.
Oltre ai tumori del colon-retto, aumenti nell’incidenza in età giovanile sono stati riscontrati per il tumore del seno, dell’ovaio, endometrio, utero, fegato, rene. Vengono mediamente riportati aumenti fino al 2-3% annuo negli utimi due decenni, ma i dati relativi all’incidenza, come è prevedibile che sia con un fenomeno ancora nuovo, presentano una notevole variabilità a seconda degli studi, delle coorti di nascita e delle fasce di età considerate, e spesso in dipendenza da fattori secondari come stili di vita o abitudini alimentari che decisamente sembrano influire.
Fumo e consumo di bevande alcoliche sono sicuramente fattori consolidati nell’eziologia del cancro, ma non sono nuovi. Bisognerebbe valutare se siano nuove le modalità di esposizione (età e quantità).
È stata considerata anche l’esposizione progressiva dagli anni ’60 in poi a plastiche, microplastiche, nanoplastiche, che è sicuramente un fattore compatibile con i tempi di insorgenza dei tumori early onset. La diffusione di questi materiali, tuttavia, è globale ed ubiquitaria, mentre i tumori early onset sembrano più frequenti nei paesi ad alto reddito. Andrebbero pertanto considerate con attenzione le principali vie di esposizione nelle diverse popolazioni e incrementati studi finalizzati ad individuarne i possibili meccanismi di cancerogenicità. Occorre capire, per esempio, se queste sostanze abbiano potenziale genotossico, se e come siano in grado di indurre stress ossidativo o infiammazione, magari cronica vista l’esposizione costante e continuativa a causa della diffusione e della persistenza nell’ambiente delle plastiche.
Assieme alle plastiche nelle loro varie dimensioni, siamo esposti anche ad una estesa gamma di molecole in esse contenute come ftalati, BPA, PFAS, ritardanti di fiamma. Sono presenti nelle plastiche ma anche in molti altri materiali di uso comune, e sono contaminanti ambientali noti per la loro persistenza e diffusione nell’ambiente, la tendenza al bioaccumulo e in molti casi la loro capacità di “disruttori endocrini” (endocrine disrupting chemicals, EDC). A queste molecole siamo esposti in modo continuativo fin dall’allattamento, essendo state trovate nel latte materno, ma in effetti già da prima, in utero.
L’ipotesi epigenetica
Qui si apre la porta al mondo dei cambiamenti epigenetici. Molecole in grado di interagire con i recettori nucleari per vari tipi di ormoni e con i complessi di rimodellamento della cromatina di cui essi fanno parte, infatti, sono anche in grado di alterarne la corretta attività e la conseguente regolazione trascrizionale fin dall’embriogenesi e delle prime fasi della crescita, anche se presenti a basse concentrazioni. Sappiamo da esperienze passate che estrogeni sintetici hanno la capacità di indurre già in utero cancerogenesi non genotossica, ovvero non inducono lesioni o mutazioni a carico del DNA ma interferiscono mediante meccanismi epigenetici con la regolazione dei pathway proliferativi/differenziativi nel corso dello sviluppo embrionale. In questo modo è stata spiegata una frequenza insolitamente elevata di tumori genitali e del seno molto precoci nelle figlie di donne che negli anni ’70 avevano fatto uso di dietilstilbestrolo (DES) ed associazioni analoghe sono state fatte in studi recenti sull’aumentato rischio di tumori nella prole di donne che tra gli anni ’50 e ’60 avevano fatto uso di 17 alfa-idrossiprogesterone (17-OHPC).
Una caratteristica degli effetti epigenetici è che sono alterazioni le cui conseguenze si possono vedere anche anche in tempi successivi.
I problemi nel verificare un approccio basato sull’esposizione già in utero o durante i primi mesi di vita a molecole in grado di indurre alterazioni epigenetiche come alcuni farmaci o molecole con proprietà di EDC risiedono in primo luogo nella difficoltà di provare oggi l’esposizione, avvenuta presumibilmente in tempi in cui difficilmente esistevano studi di popolazione e di coorte madre/bambino e con campioni biologici ancora analizzabili, e poi nel fatto che, ad oggi, della tossicità e delle capacità di interagire col nostro ambiente cellulare di tante molecole ancora in uso o dismesse con potenziale attività EDC, sappiamo molto poco.
Accelerated aging
Un’altra ipotesi proposta è quella dell’accelerated aging (diverso dalle sindromi progeroidi per cause genetiche), che associa il rischio di insorgenza di un tumore con l’età biologica e non quella cronologica di un individuo (o di un tessuto/organo). In pratica non sarebbe tanto il cancro ad essere early onset quanto i tessuti convolti ad aver acquisito un’età biologica maggiore di quella cronologica, compatibile col maggior rischio di insorgenza tumorale. Sappiamo già che in molti individui si può misurare con diversi metodi (orologi biologici) un’età biolgica diversa da quella cronologica e che, allo stesso modo, uno o anche più organi di un individuo possono invecchiare in modo precoce rispetto al resto dell’organismo. Seguendo questa ipotesi, tuttavia, rimarrebbero da comprendere i meccanismi coinvolti nell’accelerated aging, per poterli associare o meno ai cambiamenti registrati negli ultimi decenni e ciò significherà approfondire le similitudini tra invecchiamento e cancro.
In conclusione, per capire le cause dell’aumento di incidenza dei tumori early onset, bisognerà considerare contemporaneamente fattori di natura diversa, per individuare i motivi della precocità della loro azione.
A seguire sono riportati i link ad alcuni articoli per chi fosse interessato ad approfondire alcuni aspetti di quanto sintetizzato nel testo:
- The importance of aging in cancer research
- Differences in cancer rates among adults born between 1920 and 1990 in the USA: an analysis of population-based cancer registry data
- Global trends in incidence, death, burden and risk factors of early-onset cancer from 1990 to 2019
- Incidence rates of some cancer types have risen in people under age 50
- Rising incidence of early-onset colorectal cancer — a call to action
- Early-onset cancers: Biological bases and clinical implications
- Proteomic organ-specific ageing signatures and 20-year risk of age-related diseases: the Whitehall II observational cohort study
- Accelerated Aging May Increase the Risk of Early-onset Cancers in Younger Generations

